노인 두경부암 환자의 생존에 있어 노쇠의 의의
Frailty in Geriatric Patients with Head and Neck Cancer and its Implication in Survivorship
Article information
Abstract
= Abstract =
The aging population, particularly those aged 65 and above, is on the rise, with projections indicating a substantial increase in the elderly demographic. This demographic shift brings challenges in managing age-related diseases, including head and neck cancers (HNCs). Frailty, often characterized by physiological decline and vulnerability to stressors, is a crucial factor affecting treatment outcomes of elderly cancer patients. Accordingly, the significance of assessing frailty in elderly HNC patients before their treatment should be emphasized, but current frailty assessment tools may not fully capture the unique challenges faced by HNC patients. Specific indicators, including respiratory and swallowing functions, are proposed for a more tailored assessment. This comprehensive review explores the impact of frailty on various treatment modalities, including surgery, radiation, and chemotherapy, highlighting the need for personalized interventions. Furthermore, it suggests avenues for future research to enhance frailty assessment tools and investigate interventions aimed at improving treatment outcomes in elderly HNC patients.
서론
초고령사회는 65세 이상 연령층이 전체 인구의 20% 이상을 차지하는 경우를 말한다. 우리나라의 65세 이상 인구는 2022년 기준 전체 인구의 17.5%인데, 2025년에는 20.6%를 기록하여 초고령사회로 진입하고, 2035년 30.1%, 2050년에는 43%를 넘어설 것으로 전망되고 있다.1) 노인 인구의 증가는 연령에 비례하여 높아지는 각종 질환의 발병 위험 및 그에 따른 의료비용의 증가로 이어져 심각한 사회경제적 부담으로 작용할 수 있다. 최근 국내 암환자 통계에 따르면 폐암, 대장암, 위암, 전립선암, 간암 등 주요암이 65세 이상 인구에서도 연령에 비례하여 발병 위험이 높아지는 것을 확인할 수 있었다.2) 미국 Surveillance, Epidemiology, and End Result 통계자료에 의하면 두경부암 또한 연령 증가에 따라 발병률이 높아지고, 점차 진행된 병기에서 발견될 확률이 증가하고 있어 노인 암환자 증가에 대한 보건의료계의 관심과 대책 마련이 필요한 상황이다.3,4)
노인은 각종 장기 기능, 인지 능력 및 면역 시스템이 약화되고 일상적인 생활 활동 능력이 저하되어 있을 가능성이 높다. 그리고 다양한 동반 질환 및 그에 따라 복용하고 있는 약물 간의 상호작용을 특정 질병의 치료에서 고려해야 하며 가족 외의 돌봄 제공자, 사회 복지 서비스 등의 필요성에 대해서도 생각해야 한다. 결국, 노인 환자의 치료에 있어 그들의 연대적 연령(chronological age)이 아닌 기능적 연령(functional age)을 파악하는 것이 필요하다. 기능적 연령을 대변하는 대표적인 지표가 노쇠(frailty)인데, 노쇠는 노화와 관련된 생리적 쇠퇴 증후군으로 보통 정의되며, 스트레스와 신체 변화에 대한 현저한 취약성을 특징으로 하는 ‘비정상적’ 노화를 의미한다. 노쇠한 노인 환자는 허약함과 피로, 질병에 대한 취약, 치료에 대한 순응도 및 반응 감소, 부작용의 증가로 특징지어진다.5) 노쇠를 진단하는 평가도구는 통상적으로 근육양이나 근력과 같은 신체적 기능의 감소, 이동 능력 감소, 체중 감소, 에너지 소모량 저하 등을 기준으로 하나, 평가하고자 하는 질환이나 상황별로 평가도구와 기준이 다양하다.6)
노인 두경부암 환자의 경우 호흡기와 소화기계 등 동반된 장기 질환이 흔하고, 질병 자체에 의한 섭식과 영양 장애 이환 위험이 높기 때문에 치료 전 노쇠에 대한 평가가 질병 특이적이고 구체적으로 이뤄져야 한다.7,8) 따라서, 본 종설에서는 노인 두경부암에서 노쇠를 평가하기 위해 소개된 지표들을 소개하고 두경부암 특이적인 평가 방법의 필요성에 대해 논의하고자 하였다. 그리고 두경부암의 치료에 있어 노쇠가 미치는 영향에 대해 분석하고, 노쇠 존재 여부에 따른 최적의 치료를 선택하기 위한 방법을 살펴보았다. 마지막으로 현재까지 진행된 노쇠 연구에 대한 한계와 향후 연구 방향에 대해 제안해보고자 하였다.
노쇠 평가를 위한 지표와 도구
노쇠를 평가하는 지표와 기준은 다양하나 현재까지는 Fried 등이 제안한 Freid frailty index (FFI)의 평가 항목들이 보편적으로 적용되고 있다.6) 즉, 신체 기능과 생리적 저장능력의 감소를 평가하는 지표로서 불수의적 체중 감소(unintentional weight loss), 소진(exhaustion), 생리 기능의 저하(decreased physiologic function), 느림(slowness), 악력의 약화(weak grip strength) 등 다섯 가지 항목 중 세 개 이상이 해당될 경우 노쇠로 정의할 수 있다. 상기 지표들은 비교적 단순한 객관적 측정과 주관적 설문을 통해 파악할 수 있는 장점이 있으나, 노쇠의 생리적 변화 기전을 대변할 만한 과학적이고 체계적인 계측이 다소 부족하다. 따라서, 이를 보완하기 위한 추가적인 지표들이 제안되어 왔다. 대표적인 것이 전산화 단층촬영 등을 기준으로 골격근 양을 평가하여 근감소증(sarcopenia)을 확인하는 것인데, Geriatrics 8 (G8) 설문지나 Groningen frailty index (GFI) 등과의 연관성을 평가하여 근감소증을 노쇠를 측정하는 도구로서 활용하고자 하는 여러 보고들이 있었다.9-11) 또한, Dewansingh 등은 영양부족(malnutrition)이 두경부암 환자에서 공통적으로 흔히 발견되며, 영양결핍 정도를 노인 두경부암 환자의 노쇠를 평가하는 유용한 도구로 활용될 수 있다고 주장하였다.12) 그 외에도, 호중구-림프구 비율(neutrophil-lymphocyte ratio)을 노인 두경부암 환자의 노쇠 평가와 예후를 예측할 수 있는 독립적인 지표로 제안한 연구도 있으며, 최근에는 후각 저하의 정도가 노쇠와 밀접한 관련이 있고 후각 저하를 두경부암 환자의 노쇠를 평가하는 지표로 활용할 수 있다는 보고도 있었다.13,14)
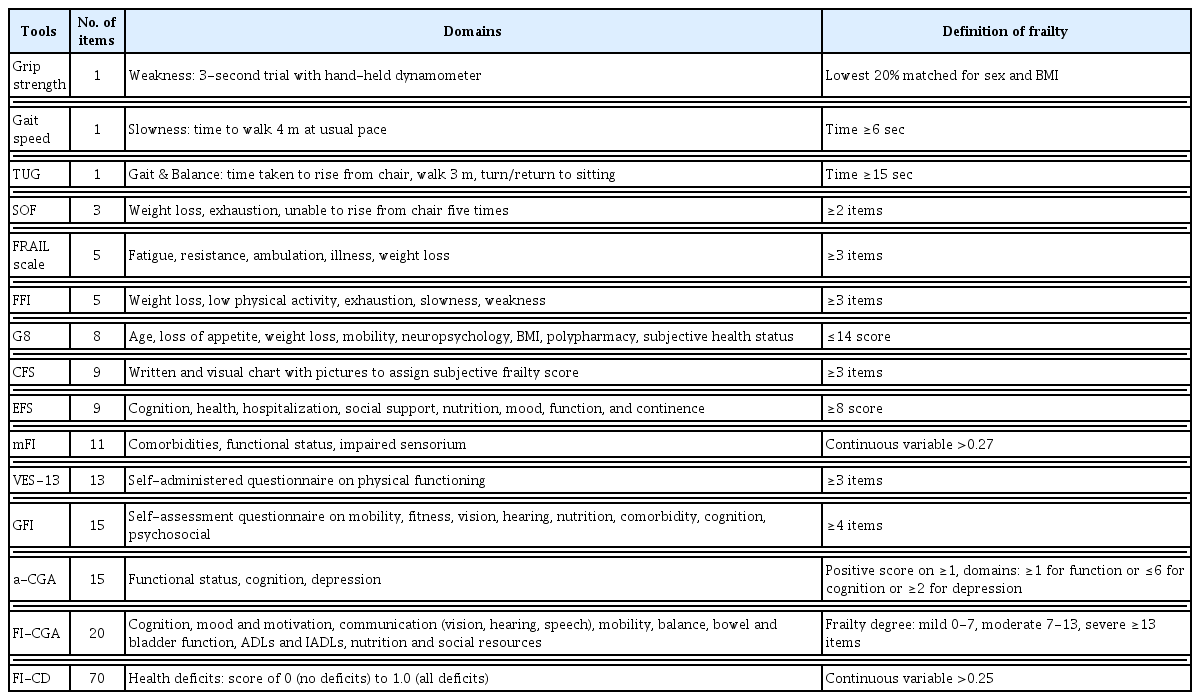
노쇠를 평가하기 위한 도구들 또한 다양하게 소개되어 왔는데, 현재까지 노인 관련 질환에서 적용되어 온 평가 도구들을 Table 1에 정리하였다.15) 가장 자세하고 다양한 평가 지표를 가지고 있는 것이 comprehensive geriatric assessment (CGA)인데, CGA는 노인의 신체적 건강 상태 뿐만 아니라 정신적⋅사회적 측면에서 다양한 평가를 할 수 있는 점과 이를 바탕으로 한 다학제적 치료 접근이 가능하고 환자 별 개별화된 치료 계획을 수립할 수 있는 장점을 제공한다. 반면, 많은 평가 항목으로 인해 검사에 시간과 비용이 많이 소모되고, 검사자 간의 일관성이 부족할 수 있으며, 특히 암환자 치료에 있어 평가에 한계가 있음이 문제로 제기되어 왔다.16) 한편, 보다 간편한 도구로 활용이 되던 hand grip strength, modified frailty index (mFI), 및 Edmonton frail scale (EFS)가 노쇠를 진단하는 데 얼마나 정확하며 검사자 간에 얼마나 일치하는 지를 평가해보았을 때도 낮은 검사 정확도와 검사자 간 일치도를 보이는 것으로 확인되었다.17) 이를 보완하기 위해 최근에는 두경부암 환자에 적합한 여러 평가 지표들의 제안이 있었는데, Raab 등은 accumulated geriatric deficit (AGD) 점수를 활용하여 노인 두경부암 환자의 수술 후 중환자실 재실기간, 합병증 및 사망률을 분석하였고, AGD 평가는 비교적 검사자 간의 높은 일치도를 보이며 높은 AGD 점수가 이를 잘 설명할 수 있다고 주장하였다.18)
두경부암 치료에서 노쇠의 임상적 의의
노인 두경부암 환자는 치료에 따른 부작용과 합병증에 더 취약하며, 특히 노쇠가 있는 환자의 경우 위험성이 더욱 증가한다고 알려져 있다.19) 그에 따라, 기관에 따라 방침의 차이가 있겠으나, 통상적으로 70‒75세 이상의 고령 환자에서는 세포독성 항암약물 치료를 금기시하는 경우가 많고, 수술에 따른 합병증 발생 위험을 우려하여 가이드라인에 근거한 표준 치료보다는 보존적이고 차선적으로 환자에게 치료를 적용하려는 경향이 있다. 하지만 일반적으로 비표준 치료 및 비수술적 치료를 노인 두경부암 환자에서 선택할 경우 보다 나쁜 결과를 초래하며, 환자가 이에 대한 치료 선택을 후회하는 경우가 많다고 보고되었다.20,21) 따라서, 노인 두경부암 환자에서도 보다 표준에 가까운 적극적 치료를 적용하려는 노력이 필요할 것이며, 치료 선택 이전에 노쇠의 여부를 파악하고 노쇠 여부에 따라 어떠한 치료를 적용하는 것이 환자에게 있어 가장 최적의 선택이 될 것인지를 예상하는 것이 매우 중요할 것이다.
두경부암 수술에서 노쇠의 영향
Pitts 등은 mFI를 통해 평가한 노쇠 여부가 두경부암 수술 후 사망률(odds ratio [OR]=1.475, 95% confidence interval [CI] 1.088‒2.001, p=0.012), 재입원율(OR=1.472, 95% CI 1.132‒1.914, p=0.004) 및 재원기간 증가(relative risk=1.136, 95% CI 1.053‒1.227, p=0.001)에 유의한 영향을 미친다고 하였다.22) FFI를 통해 노쇠를 평가한 또 다른 연구는 노쇠 여부가 수술 후 내과적 합병증 발생과 연관된다고 보고하였다(OR=1.36, 95% CI 1.04‒1.78, p=0.025).23) 또한, CGA를 이용한 국내 연구에서는 노쇠가 두경부암 수술 후 주요 합병증 위험을 현저하게 높일 수 있다고 주장하였다(OR=21.91, 95% CI 1.16‒413.37, p=0.039).24) 정리하면, 노인 두경부암 치료에서 노쇠가 수술 후의 다양한 합병증과 이환(morbidity)을 높이므로 이를 수술 전에 면밀히 평가하고 대처할 필요가 있을 것이다.
노인 두경부암 수술에 있어 재건술에 따른 이환 위험성 또한 집도의의 입장에서 중요한 부분일 것이다. Wang 등의 연구에 따르면, 노쇠가 있는 환자의 경우 재건술 후 재원 기간의 연장, 중환자실 입실 필요성 등이 높아지나 한편으로, 수술 직후 중환자실에 입실한 환자의 경우 재건술의 결과가 더 양호했다고 보고하였다.25) 최근에 발표된 체계적 고찰에 의하면, 노쇠가 두경부암 재건술 시 수술 전후 합병증 발생에 유의한 연관성이 있음이 확인되었고, 그 외 연구에서는 노쇠가 재건술 후 삶의 질 저하에도 영향을 미치며, 전반적으로 나쁜 수술 후 결과를 초래하는 것을 알 수 있었다.26-28) 반면, Rothman 등의 최근 연구에서는 Norton score 등의 노쇠 평가 도구를 활용했을 때 두경부암 수술 후 이환율을 예측하는데 유의한 의의를 도출하지 못했다고 하였고, 저자들은 보다 두경부암 특이적인 예후 예측 지표와 노쇠 평가 도구의 적용이 필요하다고 주장하였다.29)
방사선치료와 항암약물치료에서 노쇠의 영향
Bras 등은 노인 두경부암 환자의 노쇠 여부에 따른 치료 후 급성 부작용 및 합병증을 수술과 방사선치료를 구분하여 분석하였는데, 노쇠 여부가 수술과 관련된 급성 합병증과는 유의한 연관성을 보였으나 방사선치료와는 무관하다고 보고하였다.30) 다른 연구에서도 방사선치료에 의한 급성 부작용(즉, 체중감소, 점막염, 침샘염, 인후통, 연하곤란 등)과 노쇠 간의 연관성은 없으며, 따라서, 노쇠가 있는 노인 환자에서 부작용이나 치료 중단을 우려하여 방사선치료를 지양할 필요는 없다고 주장하였다.31)
두경부암에서 항암약물치료와 노쇠 간 연관성에 대한 연구는 의외로 많지 않은데, Szturz 등이 발표한 종설논문에서는 진행된 병기의 두경부암에서 노쇠가 있는 환자에서도 완치를 목표로 하는 표준치료를 적용하는 것이 필요하며, 특히 연대적 연령을 기준으로 시스플라틴 등의 세포독성 항암제를 금기시하거나 병합 요법을 회피하는 것은 잘못된 치료 방침이라고 의견을 제기하였다.32) 더군다나, 표적치료제 및 면역치료제의 경우 세포독성 항암제에 비해 양호한 독성과 부작용이 보고되어 있기에 노쇠한 환자에서도 적극적으로 적용할 수 있도록 해야 할 것인데, 다만 현재까지 이들을 대상으로 한 전향적 임상시험이나 전신적 치료제 사용에 대한 합의된 표준 진료 지침 등이 없기에 향후 관련된 추가 연구들이 필요할 것이다.33)
노인 두경부암에서 노쇠와 관련된 연구들의 개선안과 방향 제안
두경부암 환자는 질병 자체의 구조적 특징으로 인해 삼킴 장애와 그에 따른 영양결핍, 근감소증 및 악액질(cachexia) 등이 동반될 가능성이 높으며, 노인 두경부암 환자의 경우 다른 장기의 고형 종양 환자보다 더 노쇠의 위험이 높은 것으로 알려져 있다.34) 또한, 노인 두경부암 환자는 인지장애, 정동장애 및 사회적 측면의 취약성도 높은 것으로 확인되기에 이들을 치료하고 관리하는데 다학제적인 접근은 물론 두경부암 환자의 특성을 고려한 노쇠 평가 도구의 개발이 필요할 것이다.35)
기존의 노쇠 평가 도구는 임상 의사들이 필요로 하는 부분이나 특정 질환을 고려한 평가가 이뤄지지 않기에 그 의의를 실제 진료 현장에서 적용하기에는 다소 한계가 있었다. 저자의 경우 호흡 및 삼키기와 관련된 기능 장애가 있을 때 노인 두경부암 환자들의 조기 이환 및 사망에 유의하게 영향을 미친다는 것을 확인하였고, 상기 기능들을 평가할 수 있는 지표를 포함한 두경부암 특이적 노쇠 평가 도구를 제안하였다.8) 최근에는, hospital frailty risk score (HFRS)라고 하는 병원에 입원하여 치료를 받는 환자들에 보다 특이적인 노쇠 평가 도구를 통해 재입원율과 합병증 및 사망 등을 예측하는 시도가 다수 있었고, 노인 두경부암 환자의 예후를 예상하고 환자를 관리하는 측면에서도 HFRS가 많은 장점을 가지고 있다고 보고되었다.36,37)
현재까지 개발된 노쇠 평가 지표와 도구들의 결정적인 한계는 노쇠 여부를 바탕으로 환자에게 어떠한 최적의 치료와 관리 방안을 제시할 수 있을지에 대한 답을 못 찾은 것에 있다. 예컨대, 세포독성 항암약물을 연대적 연령을 바탕으로 그간 금기 대상을 선정하였으나, 기능적 연령과 노쇠 여부(또는 점수)에 따라 항암제를 적극적으로 사용할 대상자를 선별할 수 있을지는 아직 미지수이며 이에 대한 연구도 현재까지 없는 상태이다. 또한, 면역치료제 등 새로운 암 치료법이 지속적으로 개발되고 있는 상황에서 시행되는 임상 시험들이 보통 75‒80세 이상 노인 암환자를 배제한 채 진행되므로 이 새로운 치료법을 과연 노인 암환자, 특히 노쇠를 동반한 환자에게 동일하게 적용할 수 있을지에 대한 고민과 향후 연구 계획이 필요할 것으로 생각된다. 마지막으로, 기존의 연구들이 노쇠를 평가하는 도구의 개발과 노쇠 여부가 치료 결과에 있어 어떤 관련이 있는지를 분석하는데 국한되어 왔는데, 과연 예후에 영향을 미치는 노쇠의 지표들을 개선시키기 위해 적극적으로 중재를 한다면 치료 결과를 보다 양호하게 이끌어 낼 수 있을지에 대해서도 향후 잘 설계된 전향적 연구를 마련해 볼 필요가 있을 것이다.
결론
노인 두경부암 환자들은 노쇠에 취약하고, 노쇠가 동반될 경우 치료 후 각종 문제들에 대한 이환과 생존에 있어 나쁜 결과가 예상된다. 따라서, 노인 두경부암 환자에서 노쇠 여부를 치료 전 평가하는 것이 매우 중요한데, 기존의 평가 도구들은 두경부암 환자의 특성을 잘 반영하지 않은 경우가 많기에 두경부암 특이적인 지표와 도구의 개발이 필요할 것이다. 또한, 노쇠 존재 여부에 따른 최적의 치료를 환자에게 제시하는 것이 향후 연구 분야의 과제일 것이며, 노쇠를 개선하기 위한 적극적 중재가 과연 가능하고 어떤 결과를 초래할 것인지에 대해서도 탐색이 필요할 것이다.
Acknowledgement
This work is supported by the National Research Foundation of Korea (NRF) grant funded by the Ministry of Science and ICT (RS-2023-00208625) of Korea.