단일성 안와 골병변으로 확인된 갑상선 여포암의 원격 전이 1예
A Case of Solitary Metastatic Deposit in the Orbital Rim from Follicular Thyroid Cancer
Article information
Abstract
= Abstract =
Follicular thyroid carcinoma (FTC) is the second most common thyroid cancer, following papillary carcinoma. Metastasis to the orbital rim from FTC is very rare. We recently experienced a case of FTC with metastasis to the orbital rim in a 74-year-old woman, who initially presented with a huge thyroid mass and an asymptomatic solitary orbital rim lesion. The solitary orbital rim lesion was suspected to be a separate disease entity such as lymphoma from the preoperative imaging, but bone metastasis from FTC was finally confirmed after orbital rim resection and total thyroidectomy. During follow-up, the patient presented multiple bone metastasis, so the solitary orbital rim lesion was considered a clinical sign of systemic metastasis from FTC. Therefore, we present this unique case with a review of the literature.
서론
갑상선 여포암은 전체 갑상선 암 중 약 10-15%를 차지하며, 두번째로 흔한 유형이다. 갑상선 여포암은 여자에서 많이 발생하며, 발병 평균 연령이 40-50대 이상이다.1,2) 이 암종은 천천히 자라는 종양으로서 원격전이를 동반하지 않을 때 양호한 예후를 보이지만,3) 원격전이는 주로 폐, 골, 뇌 등과 함께 기타 연조직에도 일어날 수 있다.4) 골 전이는 척추, 골반, 늑골 빈도로 보고되며, 두개골에 전이되는 경우는 매우 드물다.5-7)
저자들은 갑상선 우엽의 거대 종물과 별도의 종양으로 추정되는 좌측 안와의 종물로 내원한 환자에서, 갑상선 여포암 및 단일 전이성 병변을 확인하였고 추후에 다발성 골 전이를 확인한 증례를 경험하였기에 문헌 고찰과 함께 보고하는 바이다.
증례
74세 여자 환자가 내원 40년 전부터 지속된 우측 전경부 종물이 1년 전부터 급격히 크기가 증가되어 본원 이비인후과 외래로 내원하였다. 환자는 고혈압 과거력이 있었고, 신체검진상 갑상선 우엽의 약 7cm 크기의 무통성 종물이 촉진되었다. 경부 전산화 단층 촬영 검사에서 갑상선 우엽의 장경 7.6cm 크기의 내부 괴사, 주변 석회화, 갑상선외침범을 보이는 종물 소견과, 좌측 안와 상벽의 불규칙적인 모양의 단일성 골병변이 우연히 확인되었고 기타 경부의 악성 림프절 전이 소견은 보이지 않았다. 단일성 안와골 병변은 영상 판독 소견상 골 전이보다는 악성 림프종 등 별개의 종양으로 의심되었다(Fig. 1). 갑상선 초음파검사에서 갑상선 우엽 전체에 걸쳐 내부 낭종, 미세, 거대 석회화 그리고 혈류증가를 동반한 결절이 관찰되었고, 세침흡입세포검사에서 갑상선 우엽 종물은 갑상선 여포 종양으로 확인되었다. 단일성 안와골 병변은 악성 림프종 등 별개의 질환으로 고려하여 갑상선 우엽절제술을 우선 시행하였다. 적출된 조직의 병리 육안 소견에서 회색빛의 단단한 절단면을 가진 경계가 명확(well- circumscribed)한 타원의 종물이 최장 6cm의 갑상선 우엽을 거의 차지하는 양상이었다(Fig. 2, 3A). 현미경 소견에서 종물은 섬유벽의 피막으로 둘러싸였으며, 피막 침습 및 혈관 침습이 보여 피막성 혈관침습 여포암(encapsulated angioinvasive follicular carcinoma)으로 진단되었다(Fig. 3B, 3C).
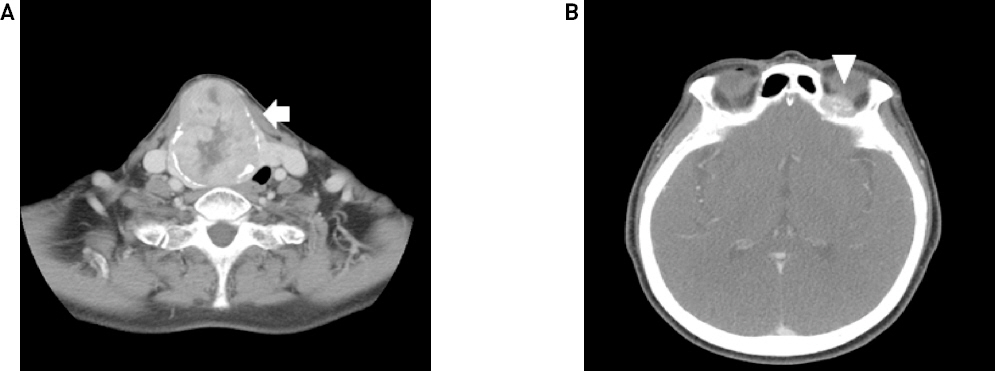
Preoperative axial CT findings. About 6.6 x 5.5 x 7.6 cm sized thyroid mass in right lobe with internal necrosis, peripheral calcification and extrathyroidal extension causing tracheal deviation to left(A: white arrow, CT) and Irregular shaped bone lesion in left orbital roof(B: white arrowhead, CT)

Gross photograph of surgical specimen showing 6cm sized mass occupying almost the entire right thyroid.
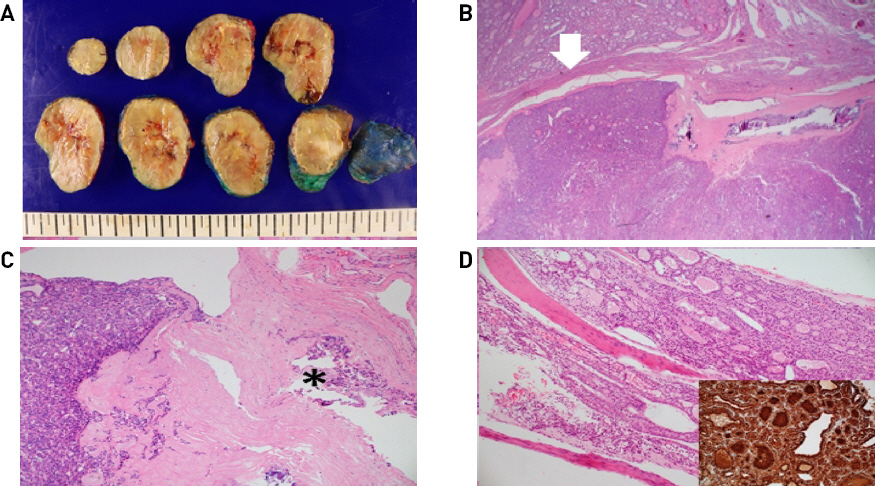
(A) Serial sections of right lobe of thyroid gland showing a well-circumscribed, ovoid mass with grayish solid cut surface, central cystic change and peripheral calcification, occupying almost the entire thyroid lobe. (B) The mass is encapsulated by a fibrous wall with capsular invasion(white arrow) and focal calcification(H&E, x12.5). (C) The mass consists of predominant microfollicles (left side) and shows frequent vascular invasion(asterix) within the fibrous capsule(H&E, x100). (D) The mass from the orbital bone reveals infiltrated thyroid follicles within the bone marrow space, which are stained by thyroglobulin. (H&E, x 100, inset: thyroglobulin).
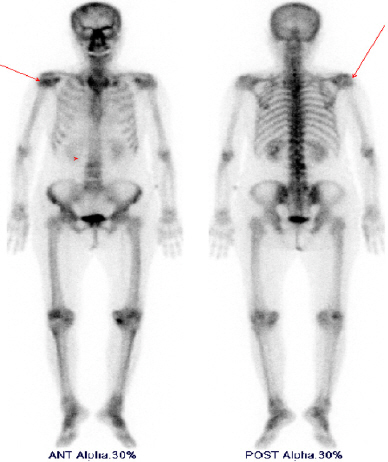
조직검사 결과 확인 후 잔존 갑상선 좌엽절제술을 계획하며, 암의 병기 설정을 위한 영상검사를 시행하였다. 수술 전 경부 전산화 단층 촬영 검사로 확인되었던 단일성 안와골 병변에 대하여 안와 자기공명영상촬영 시행하였고, 좌측 안와 상벽의 약 2.2cm의 종물이 확인되었는데 이는 골 전이 보다는 림프종 소견이 더 의심되었다(Fig. 4). 전신 양전자 방출 단층 촬영 검사상에서 악성 경부 림프절 전이를 의심할 만한 소견은 없었으나 좌측 안와 상벽의 섭취 증가와 좌측 하악골, 우측 상완골, 양측 견갑골, 흉추, 요추, 우측 8번 늑골, 흉골, 천골의 다발성 골 섭취 증가 소견이 보였다(Fig. 5). 그러나 이어 시행한 골스캔에서 우측 상완골의 경도의 섭취 증가 소견 이외엔 이상 소견은 보이지 않았다(Fig. 6). 이에 골 전이 혹은 악성 림프종의 다발성 침범의 감별을 위하여 조직학적인 확인이 필요하다고 판단하여, 첫 수술 시행 한 달 후 단일성 좌측 안와골 병변은 본원 신경외과와 상의하여 제거함과 동시에 잔존 갑상선 좌엽절제술 및 중심 경부 림프절 절제술을 시행하였다. 조직 현미경 소견에서 좌측 안와골 병변은 피질골 내로 침윤된 갑상선 여포가 보이며, 티로글로불린 면역염색이 진단에 도움이 되어, 림프종이 아닌 전이성 갑상선 여포암으로 진단되었다(Fig. 3D).
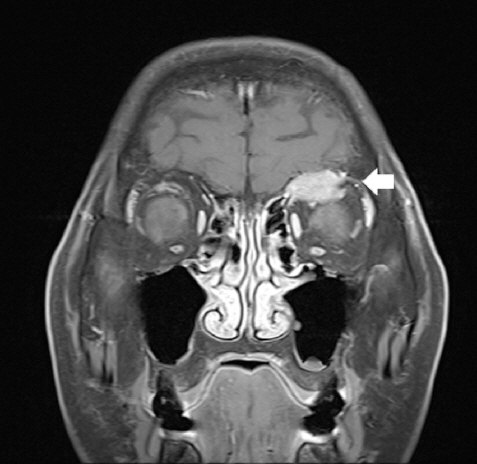
Preoperative coronal T1-weighted MR findings. About 2.2cm left orbital roof mass with irregular shape. (white arrow, T1W enhanced MRI)

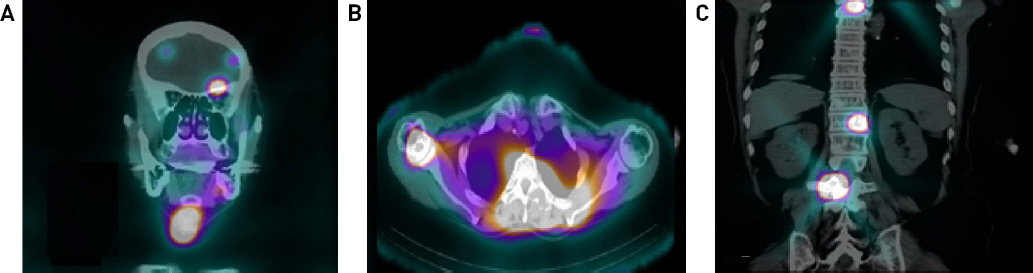
Preoperative axial and coronal PET-CT findings. Multiple hypermetabolic mass were noted at (A) left orbital area(arrow), (B) humeral head, (C) T1, T3, T4, T12 and L3 spine.
최종적으로 갑상선 여포암의 다발성 골 전이(pT3N0M1) 진단 하에 수술 3개월 후 200mCi의 근치적 방사성 요오드 치료를 시행하였고, 치료 종료 후 경부 SPECT/CT상에 아직 좌측 안와골, 우측 후두골, 우측 상완골, 흉추, 흉골, 좌측 6번 늑골, 우측 8번 늑골, 천골, 우측 대퇴골, 우측 전두엽의 다발성 전신 전이 소견을 확인하였다(Fig. 7). 이어 본원에서 추가 치료 계획 중 환자 연고지 관계로 타병원으로 전원을 하였고, 1차 방사성 요오드 치료 시행 6개월 후 2차 방사성 요오드 치료받고, 현재 환자 전신 양호한 상태로 생존 중이다.
Postoperative I-131coronal and axial SPECT/CT findings. (A) Increased radioactive iodine uptake in left orbital bone with calcified soft tissue mass formation, right frontal lobe of brain and right thyroid operation bed. (B) Increased radioactive iodine uptake in right humerus. (C) Increased radioactive iodine uptake in T3, T12, L3 spine.
고찰
갑상선 여포암은 갑상선 유두암과 다르게 비교적 높은 병기에서 처음 발견되고, 전신 전이가 흔하게 동반되는 경향이 있다. 갑상선 여포암의 원격 전이는 골 전이가 폐 전이 다음으로 두 번째로 흔하게 발생한다.8) 골 전이는 고령의 환자에서 더 자주 발생하며, 다발성 골 전이는 단일 골 전이보다 자주 관찰된다.9) 갑상선 여포암 중 골 전이는 27.8% 비율에서 보이며,10) 갑상선 여포암의 골 전이 중 두개골 전이는 27%의 비율을 보인다.10,11) Nagamine 등12)의 보고에서 473건의 갑상선 암 증례 중 9건의 갑상선 여포암의 두개골 전이가 보고되었고, 후두골, 두정-후두골, 전두골, 전두-두정골, 두개저, 두정골 순서의 빈도를 보이며, 대개 후두부의 단단하지 않은 무통의 덩이로 발견되었다. Varadarajan 등13)은 갑상선 여포암의 안면골 전이 34건의 증례를 보고하였고, 이중 안와골로 전이된 경우는 4례였다.
Jun Shen 등14)은 갑상선 여포암의 두개골 전이를 보인 환자 증례 중 내원 3개월 전부터 지속된 우측 이마의 무통성 종물과 내원 7개월전부터 지속된 우안의 시야 흐림을 주소로 내원한 67세 남자 환자를 보고한 바 있다. 영상 검사상에서 우측 안와 및 전두동의 골융해성의 단일 종물이 확인되어 수막종 또는 전이성 암종이 의심되어, 우측 전두동 개두술로 종물 제거 후 조직검사에서 갑상선 여포암의 전이로 확인되었으나, 결국 수술 20개월 후 경부 및 종격동의 다발성 전신 전이로 사망하였다. 본 증례와 같이 고령의 환자에서 갑상선 여포암의 전이로 단일성 안와 골병변이 보였고, 전신 전이로 발전한 증례이다. Jun Shen의 증례를 포함하여 현재까지 갑상선 여포암의 안와골 전이는 단 11건 보고가 되었을 정도로,13-18) 매우 드물게 관찰된다.
갑상선 암의 골 전이에 대한 치료는 방사선 요오드 치료, 수술, 외부 조사 방사선 치료 및 항암 화학 요법이 있다. 골 전이에 단독 방사성 요오드 치료는 저항성을 보이는 경우가 많아서 대부분 병합 요법이 필요하여, 수술이 가능한 경우에는 골 전이 병변 절제술이 추천된다.19) 골 전이 병변 절제술은 골 전이 부위 절제연 및 다른 전이 부위에 대한 방사성 요오드 치료의 효과를 높일 수 있기 때문이다.6,20) 다섯 부위 이하의 골 전이 병변이 있는 경우, 골 전이 병변 제거 수술을 통해 생존률을 높이고 삶의 질을 개선시킬 수 있다는 보고가 있어,9) 수술적 절제가 가능한 골 전이 병변에 대해서는 적극적인 수술이 필요하다.19,21) 외부 방사선 치료는 방사성 요오드 치료에 반응이 없는 경우 적용 가능하고, 재발률과 골 전이 부위의 통증을 일부 낮출 수 있다고 보고되었다.19) 과거 항암 화학 요법은 etoposide, carboplatin, cisplatin, methotrexate, adriamycin, doxorubicin 단독 요법이나, adriamycin, bleomycin, vincristine 병합 요법, adriamycin, bleomycin, cisplatin 병합 요법 혹은 doxorubicin, cisplatin 병합 요법 등 다양한 약제가 시도되었지만 치료 성과가 좋지 못하였고,22-24) 최근 표적 항암치료제 lenvatinib이 무진행생존(progression-free survival)에 성과가 있다는 보고가 있다.25)
본 증례에서는 수술 전 검사에서 갑상선 우엽의 거대 종물과 함께 좌측 안와의 단일 종물이 발견되었다. 좌측 안와의 단일 종물은 수술 전 검사에서 림프종으로 의심되었으나, 좌측 안와골 병변 절제술 후 조직검사에서 갑상선 여포암의 전이로 확인되었고, 이후 영상검사에서 다발성 골 전이 및 전신 전이가 확인되었다.
저자들은 본 증례를 통하여 고령의 환자가 갑상선 거대 종물과 함께 안와의 단일 종물을 동반한 경우, 갑상선 여포암의 안와골 전이의 발병률은 낮지만, 그 가능성도 충분히 고려해야 함을 경험하였다. 또한 본 증례에서 결과적으로 환자의 갑상선 여포암의 전신 전이가 확인되었기에, 안와의 단일 종물은 갑상선 암의 골 전이와 더불어 전신 전이의 임상적 징후로 의심하고 적극적인 검사 및 치료를 고려해야 할 것이다.