하경부 종물로 발현한 고립성 섬유종 1예
A Case of Solitary Fibrous Tumor Presenting as Lower Neck Mass
Article information
Abstract
= Abstract =
Solitary fibrous tumor (SFT) is rare mesenchymal tumor usually arising from pleura. SFT can be found at all anatomic site in our body but incidence of SFT is much lower in head and neck region especially at lower neck area.
We found a case of SFT that presented as a lower neck mass in a 41-year old woman. Ultrasonography showed a 3×1cm sized hypoechoic mass in the intermuscular fat plane of left lower neck, and computed tomography showed a well circumscribed, low-density mass with contrast enhancement. Fine needle aspiration showed no malignant cells with abundant red blood cells, but it was not possible to completely rule out malignant tumors or nodules clinically. Surgery was performed to make a definitive diagnosis and histopathology showed tightly packed, round to fusiform cells with staghorn shaped vessels at microscopic examination. The tumor cell were positive for CD34 but negative for CD31 and S-100 protein.
서론
고립성 섬유종은 Klemperer와 Rabin1)이 처음으로 보고한 것으로 알려진 드문 종양으로 흉막에서 주로 발생하나 우리 몸 어느 곳에서든 발생할 수 있으며 두경부 영역에서의 발생비율은 약 5% 정도로 알려져 있다.2) 두경부 영역에서는 안와, 이하선, 구강, 볼, 저작근공간, 부인두공간, 측두하와, 부비동, 악하공간 그리고 갑상선에서 주로 발견되며3) 그 외 경부에서 발견되는 고립성 섬유종은 전체 두경부 고립성 섬유종의 12%로 그 빈도가 더욱 낮다.4) 그 중에서도 하경부 영역에 발생한 확인 가능한 고립성 섬유종 증례는 전세계적으로 2건,5,6) 국내에서는 아직 보고된 바가 없다. 이에 저자들은 아래의 증례를 좌측 하경부에 발생한 고립성 섬유종 1예 로서 보고하고자 한다.
증례
41세 여자 환자로 2달전 발견된 좌측 경부 종물로 내원하였다. 과거력상 특이사항은 없었으며, 두경부 이학적 검사에서 인두 및 후두에 특이소견이 없었다. 초음파 검사상 좌측경부 Ⅳ,Ⅴ구역에 걸쳐 있는 3×1 cm 가량의 저에코성의 종괴가 확인되었으며, 도플러검사에서 종괴 내부에 혈류가 확인되었다(Fig. 1A, Fig. 1B). 전산화 단층촬영에서는 같은 부위에 조영증강되는 비교적 경계가 뚜렷한 종괴가 확인되었다(Fig. 1C). 세침흡인세포 검사상 대부분의 흡인된 세포는 적혈구였으며 악성세포는 확인되지 않았다. 종괴의 위치나 크기, 영상소견을 고려하였을 때 악성 종괴나 전이된 림프절 등을 완전히 배제할 수 없어 전신마취하에 절제술을 시행하였다. 수술 시 종괴는 피막에 쌓여 주변과 경계가 분명하였으나 붉게 충혈이 되어 있어 혈관종이 의심되는 모양이었다(Fig. 2). 병리검사상 육안적 소견으로는 경계가 뚜렷한 결절형 종물로 단단하며 회백색의 절단면이 확인되었다. 현미경 소견상 원형, 방추형 모양의 세포들이 밀집되어 있었으며 여러갈래로 분지되는 양상의 혈관구조를 보였고 경계가 불분명한 세포질로 구성되어있었다(Fig. 3A). 고배율 시야에서 유사분열은 확인되지 않았다(Fig. 3B). 면역조직화학검사에서는 CD34에서 강한 양성반응을 보였으며(Fig. 3C) STAT6 염색에서도 양성반응을 보였고(Fig. 3D), Ki67에서는 낮은 반응, CD31, D2-40, S-100 단백질 에서는 반응을 보이지 않았다. 현미경적 소견 및 면역조직화학검사를 종합하여 보았을 때 고립성 섬유종으로 진단할 수 있었다.

Preoperative imaging. (A) Ultrasonography revealed 3×1cm hypoechoic mass in the intermuscular fat plane of left lower neck. (B) Power doppler ultrasonography showed vascularity in the mass. (C) Computed tomography showed a well circumscribed mass with contrast enhancement
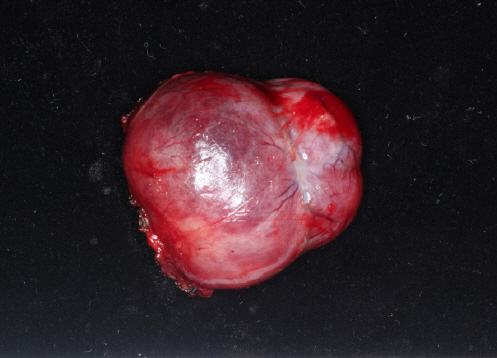
Operative finding. Tumor was congested red and surrounded by a capsule, and dissected from the surrounding tissues well.

Histopathology. (A) Tumor showed overall moderate cellularity with staghorn-shaped vessel profiles (H&E, ×100). (B) No evidence of mitosis (H&E, ×400). (C) Tumor showed strong positive result for CD34 (Immunohistochemistry, ×200). (D) Tumor showed positive result for STAT6 (Immunohistochemistry, ×200).
환자는 수술 후 특이소견 없이 퇴원하였으며, 수술 후 2개월 경 시행한 초음파 검사상 재발의 소견은 보이지 않았다. 추후에도 주기적인 경과관찰을 통해 추적관찰 예정이다.
고찰
고립성 섬유종은 현재 간엽성 종양의 한 종류로 알려져 있으나 비교적 최근까지도 세포학적 기원 및 분류체계에 대하여 끊임없는 변화를 겪어왔다.7) 또한 이전에 혈관주위세포종으로 분류되던 종양들도 현재는 고립성 섬유종의 세포 형태학적인 이형으로 분류 된다.8)
두경부 영역에서의 고립성 섬유종은 Witkin과 Rosai9)에 의해 최초로 보고되었으며 대부분 무증상의 천천히 자라는 종괴로 발견되며 종양의 위치와 그에 따른 인접한 조직이나 기관의 압박 효과로 인한 증상을 유발하기도 한다.7) 본 증례에서도 환자는 특별한 증상을 호소하지 않는 무통성 종괴로 내원하였다.
두경부 영역에서 발생하는 고립성 섬유종의 영상학적 소견으로는 전산화 단층촬영에서 뚜렷한 조영 증강 소견을 보이며 자기공명영상검사 소견으로는 T1-강조영상에서 주변 근육과 비교하여 저신호강도 혹은 동등신호강도, T2- 강조영상 에서는 다양한 저신호강도 성분을 포함한 비균질적인 고신호강도 소견을 보인다.3) 초음파 검사에서는 주로 경계가 뚜렷한 균질의 저에코 소견을 보이며, 종괴가 콜라겐을 많이 함유하면 고에코 소견을 보일 수 있다.10,11) 세침흡인검사에서 산재된 콜라겐이 있는 혈액성 배경에서 방추세포가 확인된다면 고립성 섬유종을 의심할 수 있다.12) 하지만 영상검사 소견 및 세침흡인검사 소견은 비특이적이므로 수술 전에 고립성 섬유종을 진단하기에는 어려움이 있다. 본 증례는 타원형의 경계가 뚜렷한 종괴가 조영증강 및 종괴 내부 도플러 신호를 보였고, 세침흡인검사에서 다량의 적혈구가 흡인되었으며 이들 소견은 고립성 섬유종의 영상 및 세포학적 특징에 부합하는 소견이다.
병리학적 검사상 육안소견으로는 경계가 비교적 뚜렷한 종괴 양상으로 나타나며 섬유질의 가성막을 가지는 경우도 있다. 종괴의 경도는 교원성 기질과 세포질의 비율에 따라 고무 같은 경도에서 단단한 경도까지 다양하게 나타난다.7) 고립성 섬유종은 조직학적 소견으로 분류하면 고전적인 혈관주위세포종형, 고전적인 고립성섬유종형, 그리고 복합형으로 나눌 수 있으며 중추신경계에서 발생하는 고립성 섬유종을 제외한 나머지 고립성 섬유종에 대하여 경계성 혹은 악성으로 종양의 성질로 나누어 분류하고 있다.8) 조직검사상에서 타원형, 방추형 세포가 기질의 교원질 성분과 무작위적으로 배열되어 있으며 대부분의 경우에서 특징적인 사슴뿔 모양의 혈관배열 소견을 보인다.2)
고립성 섬유종은 대부분 악성도가 높지 않으며 전이 또한 드문 것으로 알려져있다.2) 흉막외에서 발생하는 고립성 섬유종의 악성 여부를 결정짓는 명확한 기준은 없다.13) 다만 종물의 크기가 커질수록, 발병기간이 길어질수록 재발이나 악성의 가능성이 높다고 알려져 있으며14) Chan의 연구에 따르면 조직학적으로 보았을 때 높은 세포밀도와, 세포의 다형태성, 핵들의 겹침, 유사분열수의 증가 (>4 /10 HPF) 와 같은 소견들 중 2가지 이상이 확인되면 악성을 의심할 수 있다.15) Kim의 연구에서도 앞서 제시한 기준들 이외에도 종물의 크기 (≥10cm), 종물내 괴사와 같은 소견이 사망률와 재발률에 관련이 있다고 하였다.8) 본 증례의 경우 크기가 10cm미만 이며 유사분열이 확인되지 않는 것으로 보아 재발의 가능성이나 악성도는 낮을 것임을 예상해 볼 수 있다.
고립성 섬유종의 진단에는 면역조직화학염색이 필수적이며 전형적으로 CD34, CD99, Bcl2에서 양성을 띄고 EMA 와 S-100 단백질에서는 음성반응을 보이는 특징이 있다.2) 또한 NAB2/STAT6 유전자 결합이 고립성 섬유종의 발생 과정에 관여함이 밝혀짐으로써 STAT6 염색이 현재 고립성 섬유종 진단에 가장 유용한 것으로 알려져 있다.8) 본 증례의 경우에서도 CD34 에서 강한 양성반응을 보였으며 STAT6 염색에서 양성반응을 보였다.
두경부 영역에서의 고립성 섬유종의 치료는 완전한 수술적 절제가 가장 좋다고 알려져 있다. 증례의 수가 많지 않고 추적검사에 대한 정보가 충분하지는 않으나 완전 절제 후의 재발은 드물며 대부분의 재발은 완전절제가 이루어지지 않은 경우에 발생한다고 보고 있다. 이러한 불완전 절제의 경우 추가적인 방사선치료가 재발을 막는데 도움이 될 수 있다.14)
두경부 이학적 검사에서 의심되는 원발 병소가 없고, 영상검사 및 세침흡인검사에서 경계가 분명하면서 혈관이 풍부한 종괴가 하경부에 발생하였다면 고립성 섬유종이 감별진단에 포함되어야 할 것으로 생각된다.