구강암 환자의 경부 림프절 전이 및 림프절 피막 외 침범과 관련된 임상병리적 인자에 대한 고찰
A Study on the Clinicopathological Characteristics Associated with Cervical Lymph Mode Metastasis and Extra-nodal Extension in Patients with Oral Cancer
Article information
Abstract
= Abstract =
Background/Objectives
Extra-nodal extension (ENE) is one of the strongest prognosticators in oral cancers. Here we tried to evaluate clinicopathological factors associated with the presence of ENE.
Materials & Methods
We retrospectively analyzed clinical information of 120 patients who diagnosed with oral cancer and received curative surgery at our hospital from Mar 2012 to Apr 2020. We comparatively analyzed clinicopathological factors associated with the presence of lymph node (LN) metastasis and ENE, respectively.
Results
Variable factors of primary tumor characteristics such as lymphovascular invasion, perineural invasion, largest diameter of tumor, depth of invasion and maximum standardized uptake value were significantly associated with the presence of cervical LN metastasis. The largest diameter of tumor was statistically significant also in multivariate analysis for predicting the LN metastasis. Meanwhile, the association between primary tumor characteristics and the presence of ENE were not statistically significant except the primary tumor size. Importantly, factors associated with LN characteristics including the maximum diameter and number of metastatic LNs were significantly associated with ENE.
Conclusion
In this study, several factors affecting cervical LN metastasis and ENE in oral cancer patients were identified. The ENE seems to be influenced by the status of the metastatic LNs, such as the number of metastatic LNs, rather than the characteristics of the primary tumor itself.
서론
구강암은 전세계에서 11번째로 흔한 악성 종양이다.1-3) 구강암의 대표적 원인은 흡연과 음주이며,4) 구강 내 가장 흔한 조직학적 유형의 암은 편평세포암종으로 전체 구강암의 90% 이상을 차지한다.5) 구강 편평세포암종은 구강 내 다양한 위치에서 발생할 수 있지만 발생률이 상대적으로 높은 특정 부위가 있으며 가장 흔한 위치는 혀(40%)와 구강저(33%)이다. 상대적으로 덜 흔한 부위는 협부 점막, 치은, 연구개 등이 있다.6)
경부 림프절 전이 여부는 이러한 구강 편평세포암종 환자에서 가장 중요한 생존 예측인자 중 하나이다.7) 그 중에서도 피막외 침범(extra-nodal extension [ENE])은 림프절 캡슐을 통해 종양 세포가 림프절 주변의 지방 조직으로 확장되는 것을 의미하며, 경부 림프절 전이가 있는 구강암 환자에서 피막외 침범은 나쁜 생존율과 재발율 증가, 그리고 원격 전이와 관련이 있는 핵심 표지자이다.8) 한 연구에 따르면, 구강암 환자에서 경부 림프절 전이가 없는 환자군, 경부 림프절 전이가 있고 피막외 침범이 없는 환자군, 경부 림프절 전이가 있고 피막외 침범도 있는 환자군의 5년 생존율은 각각 65%, 52% 그리고 23%로 밝혀진 바 있다.9) 경부 림프절 전이 및 피막외 침범의 술전 진단을 위해 전산화단층촬영(computed tomography [CT])이나 자기공명촬영(magnetic resonance imaging [MRI]) 같은 수술전 영상 기술을 포함하여 다양한 접근이 이루어지고 있으나 술전 진단적 가치가 높지 않은 실정이며, 이는 더욱 공격적 치료가 필요한 환자의 식별을 지연시킬 수 있다.
구강암 환자들에 있어 경부 림프절 전이 및 피막외 침범에 영향을 미치는 예후 인자에 대한 객관적인 연구가 아직도 부족한 상태이다. 이에 본 연구에서는 구강암 환자에 대해서 경부 림프절 전이 및 림프절 피막외 침범과 관련있는 임상병리학적 인자를 객관적인 통계분석을 통해 발굴 및 검증하고, 이를 통해 향후 림프절 전이 및 피막외 침범을 예측하는데 도움이 되고자 하였다.
방법
본 연구는 아주대학교병원 임상시험 심사위원회(Institutional Review Board)의 승인을 받았다(AJIRB-MED-KSP-20-413). 본 연구의 대상 선정 기준으로는 2012년 3월부터 2020년 4월까지 본원에서 병리조직검사 상 구강 편평세포암종으로 진단된 환자에 대해서 원발암 광범위 절제 및 경부 림프절 절제술을 포함한 수술을 시행 받은 환자를 포함시켰으며 대상 기간 내 기존 구강암의 재발로 인해 구제수술을 시행 받은 환자들과 조직검사 결과 양성종양으로 진단된 환자들을 제외하여 총 120명(평균 59.36세, 남:여=87:33)의 의무기록을 후향적으로 분석하였다. 본 연구의 암병기 분석은 American Joint Committee on Cancer (AJCC) 8판을 기준으로 하였다. 대상 환자의 임상 증상과 술전 영상 검사 방법, 조직병리학적 결과, 수술 방법 및 술후 보조요법, 술후 재발 유무와 생존 여부 등을 조사하였다.
술전 영상검사로는 경부 초음파(ultrasonography), 경부 CT, 경부 MRI 및 전신 양전자방출단층촬영(positron emission tomography/computed tomography [PET/CT])을 시행하였다. 각 환자의 구강 내 종양의 경부 림프절 전이 여부와 피막외 침범 여부를 조사하고 종양의 원발부위(tumor subsite), 암 병기(pT staging), 종양의 신경주위 침범(perineural Invasion [PNI]) 여부, 종양의 림프혈관계 침범(lymphovascular invasion [LVI]) 여부, 종양의 조직 분화도(tumor grade), 종양의 장경(tumor largest diameter, mm), 종양의 침윤 깊이(depth of invasion), 양전자방출단층촬영의 최대 표준섭취계수값(maximum standardized uptake value [SUVmax])과의 연관성을 분석하였다. 또한 Kaplan-Meier Plot을 도출하여 각 환자의 경부 림프절 전이 유무 및 피막외 침범 여부에 따른 전체생존기간(overall survival [OS]) 및 무재발생존(recurrence free survival [RFS])을 통계적으로 비교 분석하였다. 통계처리는 R software (version 3.6.1; http://www.r-project.org/), SPSS (version 25.0; IBM Corp, Armonk, NY, USA) 프로그램을 이용하였으며 통계학적 유의수준은 95% 이상(p-value< 0.05)으로 하였다. 범주형 자료의 비교는 Chi-squared test, Fisher’s exact test를, 연속형 자료의 비교는 Wilcoxon rank sum test를 이용하여 검정하였다.
결과
경부 림프절 전이와 연관된 인자
총 120명의 구강암 환자에서 경부 림프절 전이 양성인 환자군은 40명으로 평균 나이는 62.2세 였으며 그 중 남성이 27명(67.5%), 여성이 13명(32.5%)로 남성의 비율이 우세하였으나 이는 통계적 유의성을 보이지는 않았다(Table 1). 그 외 예측인자들 중 하나인 종양의 T병기(pT)에서는 경부 림프절 전이 양성인 환자군(N=40)에서 T1-T2병기가 14명(35%), T3-T4병기가 26명(65%)로 경부 림프절 전이 음성인 환자군(N=80, T1-T2: 58명[72.5%], T3-T4: 22명[27.5%])보다 유의하게 높은 T병기를 보였다. 림프혈관계 침범 인자의 경우 경부 림프절 전이 양성인 환자군에서 림프혈관계 침범이 있는 경우가 11명(27.5%)으로 경부 림프절 전이 음성인 환자군에 비해(8명, 10%) 유의하게 많았다. 신경주위 침윤 인자에서도 경부 림프절 전이 양성인 환자군에서 신경주위 침범이 있는 경우가 13명(32.5%)로 경부 림프절 전이 음성인 환자군(9명, 11.3%)보다 유의하게 많았다. 또한, 종양의 침윤 깊이 인자의 경우 경부 림프절 전이 양성인 환자군에서 침윤 깊이의 평균값이 17.6 mm로 경부 림프절 전이 음성인 환자군에 비해(7.9 mm) 유의하게 큰 값을 보였다. 이외에도, 두 군간에 양전자방출단층촬영의 최대 표준섭취계수값 및 종양의 장경의 유의한 차이를 보였다. 또한 경부 림프절 전이 양성인 환자군에서 보조방사선치료나 보조항암방사선 치료를 받은 경우가 각각 16명(40%)과 20명(50%)으로 경부 림프절 전이 음성인 환자군보다(보조방사선 치료 10명[12.5%], 보조항암방사선 치료 4명[5%]) 유의하게 많았다(Table 1).
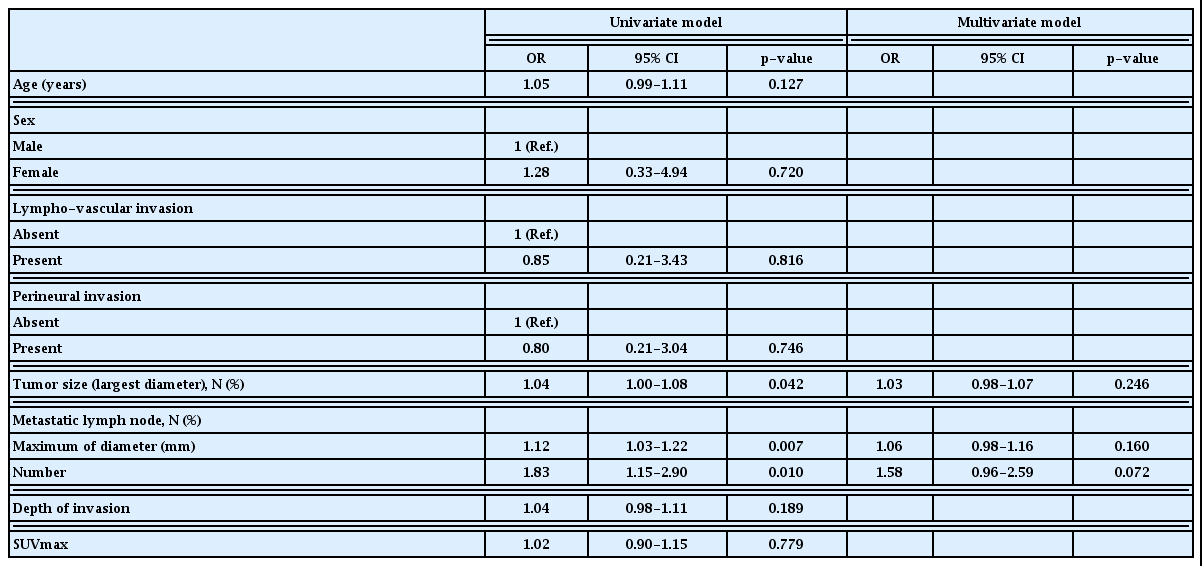
이후 전체 환자 120명의 정보를 대상으로 경부 림프절 전이의 예측 위험인자(예후인자)를 이항 로지스틱 회귀분석을 이용하여 분석하였다(Table 2). 단변량 분석(univariate analysis)에서는 표와 같이 종양의 분화도 인자에서 moderately differentiated (MD)가 reference인 well differentiated (WD)를 기준으로 했을 때 2.32 의 odds ratio (OR)를 보였으며 이는 통계적으로 유의하지는 않았다(p=0.051). Poorly differentiated (PD)군의 경우 1.55의 OR을 보였으나 이는 통계적 유의성을 띄지는 않았다. 또한 림프혈관 침윤과 신경주위 침윤 인자에서도 reference그룹인 absent그룹에 비해 present그룹의 OR이 각각 3.41, 3.69이었으며 p-value가 각각 0.017, 0.008으로 통계적 유의성을 보였다. 이외에도 장경과 침윤 깊이, 그리고 양전자방출단층촬영의 최대 표준섭취계수값이 커질수록 경부 림프절 전이의 위험도가 높아짐을 확인할 수 있었고(OR은 각각 1.06, 1.11, 1.16) 모두 통계적 유의성을 보였다.
단변량 분석에서 통계적으로 유의하였던 5가지 인자들 중 결측값이 17명 존재하는 침윤 깊이를 제외하고 4가지 인자로 다변량 분석(multivariate analysis)을 시행하였다. 림프혈관계 침범 인자의 OR은 3.02 였으며 p-value 0.077로 통계적 유의성을 보이지는 않았다. 신경주위 침범 인자의 OR은 1.55 였으며 p-value 0.480으로 통계적 유의성을 보이지는 않았다. 종양의 장경의 경우 OR은 1.04 였으며 p-value 0.023으로 통계적 유의성을 보였다. 양전자방출단층촬영의 최대 표준섭취계수의 경우 OR 1.07, p-value 0.148로 통계적 유의성을 보이지는 않았다. 이상의 결과를 종합하였을 때 원발종양의 다양한 특성이 림프절 전이 여부와 관련성이 있었으며, 그 중 원발종양의 크기가 림프절 전이의 가장 중요한 예측인자로 나타났다.
경부 림프절 피막외 침범과 연관된 인자
이후 추가적으로 경부 림프절의 피막외 침범 양성인 환자군(N=23)과 피막외 침범 음성인 환자군(N=17) 간 예측인자들의 특성을 비교하기위해 전체 120명 환자 중 경부 림프절 양성인 환자군 40명을 대상으로 통계분석을 시행하였다(Table 3). 평균 나이는 피막외 침범 양성인 환자군(64.7세)이 피막외 침범 음성인 환자군에 비해(58.8세) 많았으나 통계적 유의성을 띄지는 않았다. 이 외에도 성별이나 종양의 원발부위, 종양의 T병기, 종양의 분화도, 림프혈관계 침범, 신경주위 침범, 침윤 깊이, 양전자방출단층촬영의 최대 표준섭취계수, 보조치료방법 인자에서는 피막외 침범 양성과 피막외 침범 음성인 군 간의 유의한 차이를 보이지는 않았다. 하지만, 종양의 장경은 피막외 침범 양성인 군에서 평균값 45.6 mm, 음성인 군에서 평균값 32.9 mm로 두 군간 차이는 통계적으로 유의하였다(p=0.024). 또한 전이림프절의 장경(maximum diameter of metastatic lymph node)의 경우에도 피막외 침범 양성인 군이 평균값 21.1 mm, 피막외 침범 음성인 군이 평균값 10.6 mm로 통계적으로 유의한 차이를 보였다(p=0.002). 마지막으로 전이림프절의 개수(number of metastatic lymph node)의 경우에도 피막외 침범 양성인 군이 평균값 5.5개, 음성인 군이 평균값 2.0개로 통계적으로 유의한 차이를 보였다(p=0.002).
이후 40명의 경부 림프절 양성인 환자의 정보를 대상으로 피막외 침범의 예측 위험인자(예후인자)를 이항 로지스틱 회귀분석을 이용하여 분석하였다(Table 4). 단변량 분석에서는 표와 같이 종양의 장경, 전이림프절의 장경, 전이림프절의 개수 인자에서 통계적으로 유의한 결과를 보였으며 세가지 인자 중 전이림프절의 개수 인자가 OR 1.83으로 가장 큰 값을 보였다. 단변량 분석에서 통계적으로 유의하였던 3가지 인자로 다변량 분석을 시행하였다. 종양의 장경 인자의 OR은 1.03 이었으며 p-value 0.246으로 통계적 유의성을 보이지는 않았다. 그리고 전이림프절의 장경 인자의 경우에도 OR은 1.06, p-value 0.160으로 통계적 유의성을 보이지 않았다. 마찬가지로, 전이림프절의 개수 인자의 경우 통계적 유의성을 띄지는 않았지만(p=0.072), OR가 1.58로 앞선 두 인자와 비교하였을 때 상대적으로 큰 OR을 보였다. 이상의 결과를 종합하였을 때 구강암의 경부 림프절 전이의 피막외 침범 여부는 원발종양의 특성과는 연관성이 크지 않았으며 이 보다는 전이 림프절의 개수와 연관성이 높은 것으로 나타났다.
경부 림프절 전이 및 피막외 침범이 생존률에 미치는 영향
구강암 환자에서 경부 림프절 전이 여부 및 전이림프절의 피막외 침범 여부에 따른 전체생존기간과 무재발생존기간을 분석하기 위해 Kaplan-Meier plot곡선을 도출하여 분석하였다(Fig. 1 and Fig. 2). 경부 림프절 전이가 없는 환자군보다 전이가 있는 환자군에서 전체생존기간 및 무재발생존기간이 감소하여 두 군간 통계적으로 유의한 차이를 보였다(Fig. 1). 구강암 환자에서 경부 림프절 전이 양성인 환자군(N=40) 중 피막외 침범 여부에 따른 전체생존기간과 무재발생존기간도 Kaplan-Meier plot을 이용하여 같은 방식으로 비교분석하였다. Plot에 따르면 피막외 침범 양성인 환자군에서 전체생존기간과 무재발생존기간이 감소한 양상을 보였으나 통계학적 유의성을 보이지는 않았다(Fig. 2).
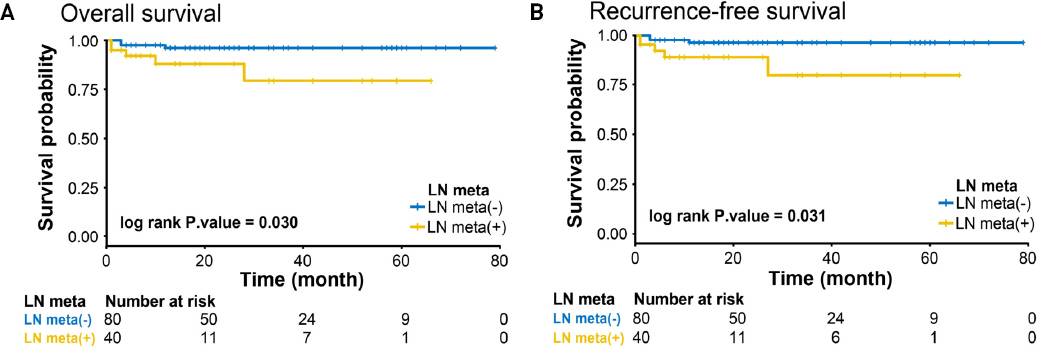
(A) Comparison of overall survival for cervical lymph node (LN) metastasis-negative patients vs cervical LN metastasis-positive patients in oral cancer (3yrs Overall survival rate: 96.1% vs 79.3%, p-value 0.030). (B) Comparison of recurrence-free survival for cervical LN metastasis-negative patients vs cervical LN metastasis-positive patients in oral cancer (3yrs recurrence free survival rate: 96.1% vs 80.0%, p-value 0.031).
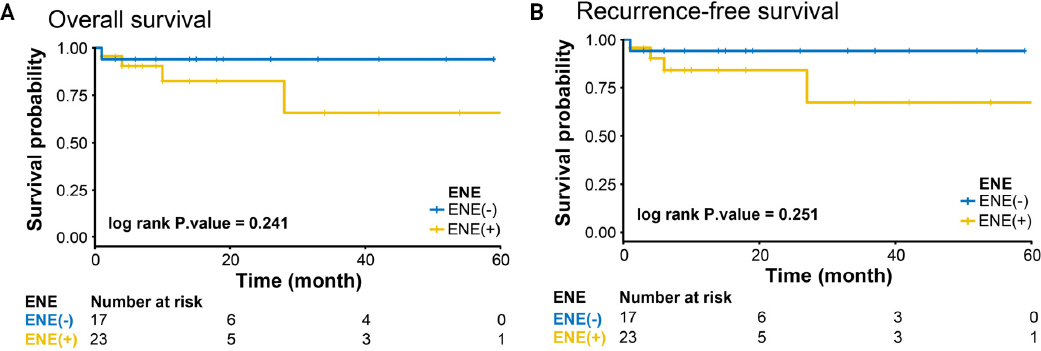
(A) Comparison of overall survival for extra-nodal extension (ENE)-negative patients vs ENE-positive patients in oral cancer (3yrs Overall survival rate: 94.1% vs 65.9%, p-value 0.241). (B) Comparison of recurrence-free survival for ENE-negative patients vs ENE-positive patients in oral cancer (3yrs recurrence free survival rate: 94.1% vs 67.5%, p-value 0.251).
고찰
구강암 환자의 생존 및 예후에 있어 많은 예측인자들이 있지만, 경부 림프절 전이 여부 및 림프절의 피막외 침범 여부는 가장 중요한 생존 예측인자 중 하나이다.7) 따라서 본 연구에서는 병리조직검사상 구강 편평세포암종으로 진단된 환자 중 원발암 및 경부 림프절 절제술을 시행 받은120명의 환자의 의무기록을 후향적으로 분석하였다. 경부 림프절 전이의 예측인자를 알아보기 위한 단변량 분석에서는 림프혈관계 침범, 신경주위 침범, 종양의 장경, 종양의 침윤 깊이, 그리고 양전자방출단층촬영의 최대 표준섭취계수값이 통계적 유의성을 보여 경부 림프절 전이의 위험도와 유의한 관계가 있음을 알 수 있었다. 종양의 침윤 깊이 변수를 제외하고, 앞서 단변량 분석에서 유의하였던 4가지 인자로 시행한 다변량 분석에서는 원발종양의 장경 변수가 경부 림프절 전이에 있어 통계적 유의성을 보였으며 그 외의 인자들은 통계적으로 유의하지는 않았다.
구강의 편평세포암종에 있어 병리학적 특징인 종양의 침윤 깊이는 질병 특이적 생존과 중요한 연관관계를 보이기에 종양의 T병기를 정의하기 위한 기본단계 기준으로 도입되어 있다.10) 또한 종양의 침윤 깊이는 임상적으로 경부 전이 음성인 구강암 환자에서 잠복 림프절 전이의 중요 예측인자임이 밝혀졌다.11) 그러므로 종양의 침윤 깊이는 임상적으로 구강암 환자에서 경부 림프절 전이의 발생과 그에 따른 예후를 예측하는 탁월한 인자이다.12) 본 연구에서 시행한 경부 림프절 전이 예측인자들의 단변량 분석에서 앞서 기재한 대로 종양의 침윤 깊이는 OR 1.11, p-value 0.001로 경부 림프절 전이를 예측하는 인자로 통계적 의미가 있었으나 전체 환자군 중 결측값이 일부 존재하여 다변량 분석에는 포함시켜 분석하지 않았다. 하지만 경부 림프절 전이의 다변량 분석에서 종양의 크기(장경)가 통계적으로 유의한 결과가 도출되었으며, 이는 경부 림프절 전이는 원발종양의 크기와 더불어 간접적으로 종양의 침윤 정도에 따라서도 의미 있는 변화를 보인다는 것을 확인할 수 있었다.
이외에도 경부 림프절 전이가 있는 구강암 환자에서 피막외 침범은 생존율의 감소, 재발율의 증가, 그리고 원격 전이와 관련이 있는 핵심 표지자이며,11) 두경부 편평세포암종에서 매우 강력한 예후인자이다.13) 기존의 연구에서, 구강암 환자에서 경부 림프절 전이가 있으면서 피막외 침범이 동반된 환자군이 그렇지 않은 환자군에 비해 유의하게 낮은 생존율을 보이기도 하였다.13) 하지만 현재 경부 림프절의 피막외 침범을 구강암 환자의 치료에 통합하는데 있어 장애가 되는 것은 피막외 침범을 술전에 알아보기 위한 영상 진단의 진단적 가치가 높지 않고 상당한 비율의 환자가 오진되고 있다는 것이다.14,15) 잠복전이가 있는 초기 구강암 환자를 대상으로 한 연구에서는, 종양의 침윤 깊이(>5mm)와 전이 림프절의 크기(>15mm)가 경부 림프절의 피막외 침범의 중요 예측인자임을 발견하였고, 이러한 경우 선택적 경부 림프절 절제술이 치료강화가 필요할 수 있는 이러한 환자군에서 피막외 침범을 탐지하는 유일한 방법임을 밝혔다.16) 그러나 현재까지 구강암 환자에서 경부 림프절의 피막외 침범을 시사하거나 예측하는 변수들을 발굴한 연구들이 많지 않아 본 저자들은 본 연구를 기획하게 되었다.
본 연구는 총 환자군 120명을 대상으로 기획하였고 그중 경부 림프절 전이 양성인 환자는 40명, 피막외 침범이 있는 환자는 23명으로 대상환자군의 N수가 많지 않아 피막외 침범을 예측하는 인자들의 다변량 분석에서 통계적으로 유의한 인자는 확인되지 않았다. 하지만 피막외 침범을 예측하는 인자들의 단변량 분석에서는 종양의 크기(장경)와 전이림프절의 장경, 전이림프절의 개수가 통계적으로 유의함을 발견하였고 그 중에서도 전이림프절의 개수가 다른 인자들에 비해 OR 1.83, p-value 0.010으로 비교적 높은 결과를 얻을 수 있었다. 상기 결과를 통해 구강암 환자에서 경부 림프절의 피막외 침범은 원발종양 자체의 특성보다는 전이림프절의 상태 및 인자가 더 관련성이 있는 것으로 추정해 볼 수 있었다. 그럼에도 본 연구보다 많은 N수의 환자군을 대상으로 한 향후의 연구가 필요할 것으로 생각된다.
기존의 연구에 따르면 두경부 편평세포암 환자에서 전이 림프절이 하나만 있어도 환자는 진행단계 질환 범주에 속하며 전체생존기간이 최대 50%까지 감소한다.17) 또한 전이림프절의 개수는 구강암 환자의 사망률의 예측인자이며 전이림프절의 수가 증가함에 따라 전체생존기간이 감소함이 밝혀져 있다.18) American Joint Committee on Cancer (AJCC) 병기 결정 시스템은 경부 림프절 개수, 림프절의 크기, 편측성 등을 통합하고 있지만 최근에는 피막외 침범을 중요하게 고려하고 있다.19) 피막외 침범의 예후에 대한 영향은 몇몇의 기존 연구에서 분석되었고 국소 재발 혹은 원격 전이의 위험을 추정할 수 있는 필수 예후인자로 인식되고 있다.20) 또한 최근의 한 연구에서, 피막외 침범이 침윤의 정도에 따라 분류되었을 때 침윤 수준이 가장 높은 환자군의 생존률이 현저히 낮고 재발률이 높은 것으로 밝혀졌다.21) 본 연구에서도 환자군을 대상으로 경부 림프절 전이 여부 및 피막외 침범 여부에 따른 전체생존기간과 무재발생존기간을 분석하였고 이를 통해 경부 림프절 전이가 있는 경우가 없는 경우보다 유의하게 예후가 좋지 않음을 알 수 있었다. 경부 림프절의 피막외 침범이 동반된 경우에도 대상 환자군의 예후가 좋지 않음을 알 수 있었으나 통계적 유의성을 보이지는 않았으며 이는 대상 환자군의 N수가 많지 않았던 것에 기인하는 것으로 생각된다.
본 연구는 구강암 환자에서 경부 림프절의 피막외 침범을 예측하는 인자를 발굴하기 위한 연구가 현재까지 많지 않았던 상태로 그러한 측면에서 의미가 있었다. 하지만 몇가지 제한점으로는 후향적으로 대상환자군을 분석하였다는 점과 앞서 밝힌 바와 같이 대상환자군의 N수가 많지 않았다는 점이 있다. 그 외에 원발종양 및 경부 림프절의 병리조직 중 일부 변수의 결측값이 소량 존재했다는 점이 있다. 따라서 향후 전향적 분석을 통한 다기관 연구가 필요할 것으로 생각된다.
결론
본 연구를 통해 구강암 환자에 있어 경부 림프절 전이에 영향을 미치는 몇 가지 인자를 밝혔으며 그 중에서도 원발종양의 크기(장경)가 유의하였다. 또한 경부 림프절의 피막외 침범은 원발종양 자체의 특성보다는 전이림프절의 개수 같은 전이림프절의 상태에 영향을 받는 것으로 확인되었다. 마지막으로, 구강암 환자에서 경부 림프절의 전이와 피막외 침범은 구강암 환자의 나쁜 예후와 관련성을 보인다.