갑상선 유두암의 일차 수술 후 경부 림프절 재발의 원인
The Cause of Cervical Lymph Node Recurrence after the Initial Surgery of Papillary Thyroid Carcinoma
Article information
Trans Abstract
Background/Objectives
Papillary thyroid carcinoma (PTC) has generally an indolent character with a good prognosis. However, recurrence remains a major concern for the patients during their lifetime. Despite the slowly progressing character of PTC, recurrence can occur within a short period after initial surgery.
This study aimed to determine the clinical findings and cause of recurrence in patients who underwent re-operative surgery due to neck node recurrence by reviewing the CT (computed tomographic) scan imaging of the recurrence of PTC retrospectively.
Materials & Methods
We reviewed the medical records of patients referred to Ajou University Hospital from January 2002 to January 2018. All patients had re-operative surgery due to neck node recurrence and CT scan results of preoperative evaluation and postoperative follow up. Over this period, 110 patients who underwent re-operation due to neck node recurrence with a CT scan were included in our cohort, resulting in a total of 220 re-operations.
Results
The time from initial operation to first re-operation was examined in 110 patients. The median time to re-operation was 28 months, with a range of 4 months to 186 months. Most re-operations (82.7%) occurred within the first five years, 43.6% were in the first two years from the initial surgery. The result of the retrospective CT review showed newly developed cases (21,19.1%), missed diagnosis cases (42,38.2%), real recur cases after surgery (33,30.0%), and remnant lymph nodes (LNs) cases (14,12.7%). We further sub-analyzed 14 cases with remnant LNs. Reasons for remnant LNs included insufficient operation (N=5) and beyond general surgical extent. (N=9).
Conclusion
Re-operation due to cervical lymph node recurrence is mostly a persistent disease. They included a missed diagnosis and incomplete operation. These finding may reduce the reoperation of cervical lymph node recurrence by accurate preoperative evaluation and complete surgical resection at the initial surgery.
서론
일반적으로 갑상선 유두암은 느리게 진행되는 암으로 알려져 있다[1]. 이러한 특징으로 인해 최근 국내에서는 갑상선 유두암의 발생률이 증가함에도 불구하고 사망률의 변화가 없는 것을 토대로 과잉진단에 대한 논란이 있다[2]. 그러나 갑상선 유두암은 느리게 진행되는 특징에도 불구하고 재발은 30%까지 높게 보고 된다[3,4].
갑상선 유두암의 재발은 갑상선 암이 천천히 진행된다는 특징으로 인해 수술 후 상당히 오랜 시간이 지나서야 발생할 것 같지만, 실제 임상현장에서는 수술 후 5년이 되지 않아 재발하는 경우가 더 흔하다[5,6]. 수술 후 재발 시기가 이른 것은 일반적인 갑상선 유두암의 느리게 진행하는 특징과는 상반된 결과이다. 따라서 갑상선 유두암의 재발은 일차 수술 후 새롭게 발생한 재발암은 물론 일차 수술 전 영상의학적으로 보이지 않았거나, 위음성(false negative)으로 간주되어 수술적 절제가 완전히 되지 않은 잔존암을 포함한다[5,7-9].
갑상선 유두암의 재발은 일반적으로 경부 림프절에서 가장 많이 발생한다[10-12]. 저자들은 이러한 갑상선 유두암의 경부 림프절 재발로 인해 재수술을 진행한 환자와 관련하여 후향적으로 영상검사를 재검토함으로서 재발시기, 재발위치, 재발원인 등을 조사하여 향후 갑상선 유두암의 재발수술을 최소화하는 방안을 알아보고자 하였다.
대상 및 방법
아주대학교병원 갑상선 내분비외과에서 2002년 1월부터 2018년 1월까지 갑상선 유두암의 재발로 수술을 시행한 110예를 대상으로 의무기록을 통한 후향적 연구를 하였다. 대상기간 내 9,173명이 갑상선 수술을 받았으며 갑상선 유두암종 외 다른 암종(갑상선수질암, 미분암, 림프종 및 타장기 전이 암 등)과 1차 수술이 타병원에서 진행된 경우를 제외한 갑상선 유두암의 재발은 220예(2.4%)였다. 이 중 타병원에서 재발수술을 진행하고 추적관찰이 종료된 경우(51예), 수술 후 최종 조직검사를 확인 후 2개월 이내 완결 갑상선절제술을 시행한 경우(9예), 혈청갑상선글로블린의 상승과 스캔 등의 검사에서 재발이 의심되나 다른 영상검사 상 명확한 병변이 없는 경우(6예)를 제외하였다. 본원에서 재발수술을 진행한 154예중 수술 전과 후를 비교할 명확한 영상자료가 없는 44예를 제외하고 최종적으로 110예를 대상으로 하였다.
일차 수술의 진행은 원발암의 크기 및 진행정도와 림프절 전이 상태에 따라 결정하였으며, 모든 갑상선 절제술 환자에서 예방적 중심경부림프절 절제술을 시행하였다.
재발에 대한 발견은 혈액검사 상 혈청갑상선글로블린이 상승과 스캔검사, 초음파 검사, 컴퓨터 단층촬영 검사(CT scan), 양전자 컴퓨터 단층촬영(PET-CT) 등의 영상검사를 이용하였고, 재발수술의 시기는 첫번째 재수술이 시행된 일로 하였으며, 객관적인 재발여부를 비교하기 위한 컴퓨터 단층촬영의 후향적 검토는 본원 갑상선 내분비외과 전문의 1인과 영상의학과 전문의 1인이 시행하였다. 본 연구의 프로토콜은 아주대학교 의과대학의 기관연구심의위원회에 의해 승인되었다(#AJIRB-MED-MDB-19-424).
결과
임상적 특징
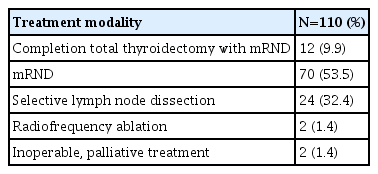
연구 대상의 연령은 14세에서 78세까지 다양하게 분포하였으며 성별 분포로는 남자가 32예(29.1%)를 차지하였다. AJCC (American Joint Committee on Cancer) 7판을 기준으로 T3 병기가 85예(77.3%)였고, N병기는 측경부로 전이된 N1b 병기가 59예(53.6%)였다. 원격전이 된 M1 병기는 7예(6.4%)였다. 재발 위험도는 2015년에 발표된 ATA (American Thyroid Association)의 재발 위험도 계층화 분류(Risk stratification system)를 사용하였다[7]. 대상군은 고위험군이 10예(14.5%)였고, 중위험군이 74예(67.4%), 저위험군이 20예(18.2%)였다. 초기 수술적 치료는 갑상선 전절제술과 중앙경부림프절 절제술을 시행한 환자가 36예(32.7%)였고, 갑상선 전절제술과 근치적 측경부 림프절 절제술을 시행한 경우가 52예(47.2%)였다(Table 1).
재발의 진단 및 위치, 재발 시 치료방법
재발의 최초 발견은 혈액검사상 혈청갑상선글로블린이 증가한 경우가 70예(63.9%)였고 초음파 검사로 발견된 경우가 25예(22.7%)를 차지하였으며 컴퓨터 단층촬영은 9예(8.2%)였고, 양전자 컴퓨터 단층 촬영은 5예(4.5%)였다.
재발의 위치는 중심경부림프절(Level VI)만 재발한 사례가 10예(9.1%), 측경부 림프절이 93예(84.5%)였고 93예 중 중심경부 림프절 재발을 동반한 사례는 13예가 있었으며, 중심경부 림프절이나 측경부 림프절 재발과 함께 원격전이가 발견된 경우가 7예(6.3%)였다. 원격전이가 발견된 경우에도 재발병소는 방사성 요오드 치료를 시행하기 위해 재발병소에 대한 수술적 제거를 시행하였다.
재발 수술 및 추가 치료의 분포는 완결절제술과 근치적 측경부 절제술 12예(12.9%), 근치적 측경부 절제술만 시행한 70예(63.6%), 중심경부림프절만 재수술한 10예를 포함한 선택적 림프절 절제술이 24예(21.8%), 고주파열치료술(RFA; radiofrequency ablation)이 2예(1.8%), 수술적 치료가 불가하여 고식적(palliative) 치료를 시행한 2예(1.8%)였다(Table 2).
재발의 시기
추적관찰 기간은 중간 값(Median)이 68개월이었고, 재발 수술의 시점은 중간 값이 수술 후 28개월이었으며 4개월에서 186개월까지 다양한 시기에 재발하였다. 기간별 재발의 분포는 1년 내 재발이 20예(18.1%)였고, 1년에서 2년이 28예(25.4%)였으며, 2년에서 5년 사이의 재발이 43예(39.1%)였다. 누적 재발률로 살펴보면 5년내 재발이 82.7%를 차지하였으며 10년내 재발이 108예로 98.2%를 차지하였다(Table 3).
후향적 컴퓨터 단층촬영 검토 결과 및 잔존암의 위치
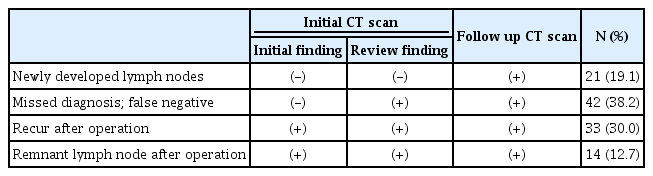
경부림프절에 재발하여 재수술을 받은 환자의 컴퓨터 단층촬영영상을 후향적으로 재검토하여 본 결과 실제로 없던 림프절이 새로 발생한 경우는 21예(19.1%)였고, 영상검사소견에서 병변을 간과하거나 불분명하여 위음성으로 판단되는 경우가 42예(38.2%)였다. 수술 후 실제 영상추적 검사 상 완전히 제거된 것으로 확인 이후 재발한 경우가 33예(30.0%)였고, 이전 영상검사에서 존재하는 전이 림프절이나 수술적으로 접근이 어렵거나 수술 시 간과하여 남아있는 림프절이 있는 경우는 14예(12.7%)였다(Table 4).
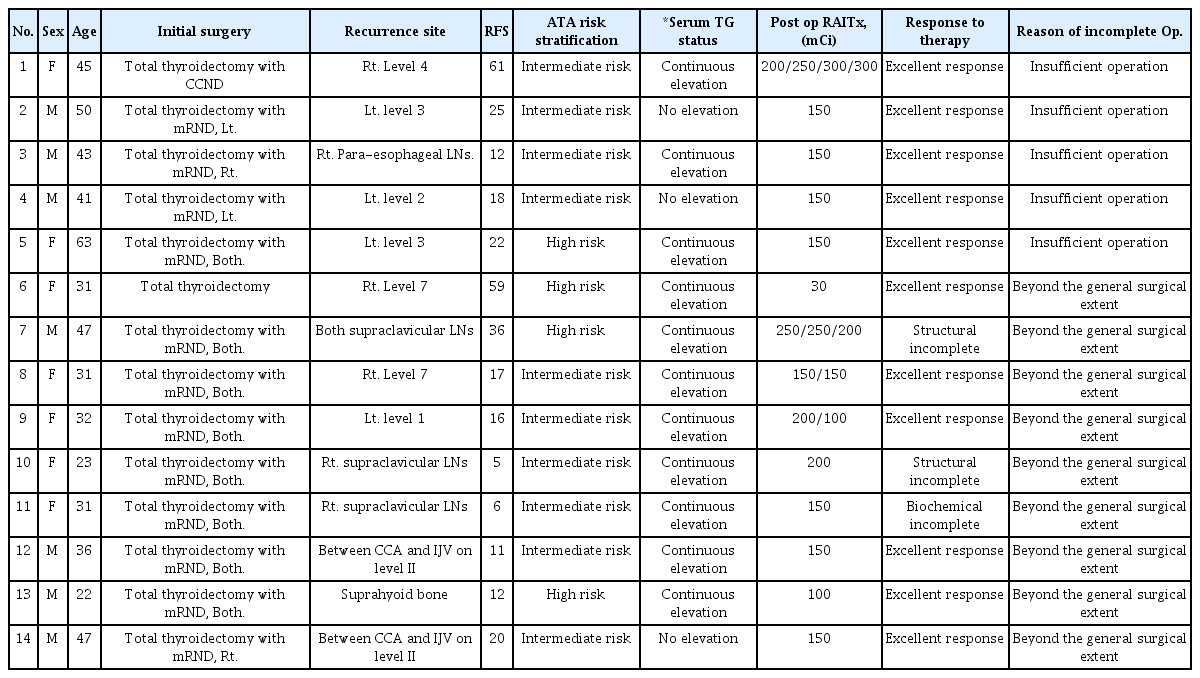
이 중 14예를 세부적으로 분류하여 살펴보면 일반적인 경부 림프절 전이 시 수술 부위(Level II, III, IV, Vb, IV)에 전이 림프절이 제거되지 않아 불완전한 수술이 된 경우가 5예였고, 전이 림프절이 근치적 측경부 림프절 절제 시 일반적으로 포함되는 수술의 범위가 아닌 위치에 존재하여 최초 수술 시 제거하지 못한 경우가 9예였다.
최초 수술 시 제거하지 못한 림프절의 위치는 제2구획(Level II)의 경동맥(Common carotid artery)과 경정맥(Internal jugular vein)사이, 쇄골 상방 구역(supraclavicular area), 제1구획(Level I), 종격동에 위치한 제7구획(Level 7) 등이었다(Table 5).
재발 후 치료의 결과
치료의 결과는 2015년에 발표된 ATA 가이드라인에서 제시한 치료 반응에 따른 재분류(Response to therapy reclassification)에 따라 나누었다[7].
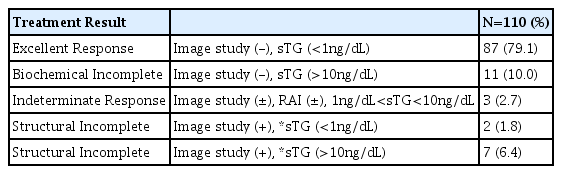
재발치료 후 환자의 치료 결과는 우수반응(Excellent response)이 87예(79.1%)였고 생화학적 불완전 반응(Biochemical incomplete response)이 11예(10.0%)였으며, 미결정 반응(indeterminate response)가 3예(2.7%), 구조적 불완전 반응(structural incomplete response)은 9예(8.2%)를 차지했다(Table 6).
고찰
갑상선 유두암은 일반적으로 느리게 진행하는 암으로 알려져 있으며, 수술 후 매우 좋은 예후를 가지는 것으로 알려져 있다[1,13,14]. 그럼에도 불구하고 수술 및 추가적인 방사성 요오드 치료 후에도 30%까지 높은 재발률을 보이고 있다[3,4].
갑상선 유두암의 재발 시기는 매우 다양하나 여러 연구에서 2년 내외가 흔한 것으로 보고하고 있다[5,6,15-17]. 갑상선 유두암이 느리게 진행하는 특징과 재발 시기가 이른 것은 일반적으로 진행이 빠른 암이 재발시기가 빠를 것으로 예상할 수 있는 가설과는 상충되는 현상이다. 이에 대한 이유로 일차 수술전에 없었던 병변이 수술 후 새롭게 발생한 경우 외, 전이 병변이 수술 전 검사 상위음성으로 간주되었거나 일차 수술 시 완전히 제거되지 않은 경우를 고려해 볼 수 있다.
따라서 본 연구는 갑상선 유두암의 림프절 재발 환자를 대상으로 재발의 시기를 분석하고, 동시에 주된 이유를 살펴보고자 컴퓨터 단층촬영 영상을 후향적으로 재검토함으로 재발의 형태를 실제 재발과 수술 전 진단에서 놓친 경우 또는 수술 시 간과된 경우 등의 잔존암에 대한 세부적인 사례를 살펴보았다.
본 연구에서 살펴본 갑상선 유두암의 재발의 시기는 2년이내가 28례로 전체의 43.6%를 차지하였고, 5년 이내의 재발까지 합치면 전체의 82.7%를 차지하였다. 다른 연구의 보고와 유사하게 재발 시기의 중간 값이 28개월으로 다수의 갑상선 유두암의 국소 재발이 2년 전후에 발견되었다. 1년 이내에 재발한 20예(18.1%)의 경우에는 혈청갑상선글로블린이 지속적으로 상승한 경우가 아니면 컴퓨터 단층 촬영 및 양전자 단층촬영 등의 검사는 적극적으로 시행하지 않기 때문에 이 시기에 잔존암이 있다 하더라도 1년 이내에는 흔히 진단되지 않을 수 있다(Table 3).
본 연구에서 10년 이후에 재발한 경우는 2예(1.8%)만 차지하는 것으로 보아 일반적으로 갑상선 유두암이 느리게 진행되는 특징과 부합하며, 많은 경우에 있어 초기 평가 및 수술 시 세심한 진단과 수술자의 전이 림프절의 정확한 제거를 통해 많은 부분의 재발 수술을 줄일 수 있음을 가정해 볼 수 있다.
후향적으로 컴퓨터 단층촬영검사의 영상자료를 재검토한 결과 다수인 93예(84.5%)가 측경부에 존재하였다. 중심경부림프절에만 재발한 사례가 10예(9.1%)로 낮은 것은 본원의 갑상선 수술 시 모든 갑상선 절제술 환자에서 예방적 중심경부림프절 절제술을 시행하기 때문인 것으로 사료된다.
측경부에 재발한 병변은 갑상선 유두암 종이 진행이 느린 특성을 고려해보았을 때, 새로 생긴 병변으로 사료되기 보다 수술 전의 영상의학적 초기의 평가가 적절하지 않았거나 수술자가 수술 중 제거하지 못한 경우를 포함하였다. 실제 재발로 생각할 수 있는 일차 수술 전 검사에서 없던 림프절이 새로 발생한 경우는 21예(19.1%)였고 수술 후 영상추적 검사 상 완전히 제거되었으나 이후 새로이 재발한 경우는 33예(30.0%)였다.
컴퓨터 단층촬영을 재검토한 것을 재분류한 것 중 영상검사에서 병변을 간과하거나 불분명하여 위음성을 보인 42예(38.2%)와 수술적으로 접근이 어렵거나 수술 시 간과하여 남아있는 림프절이 있는 경우인 14예(12.7%)는 두 경우를 합하여 50.9%를 차지하였다. 이는 진단을 담당하고 있는 영상의학과 의사와 수술을 맡은 외과의사의 다학제적 노력으로 인해 절반 정도의 재수술을 감소시킬 수 있는 가능성을 갖는다(Table 4).
잔존 림프절에 대한 14예(12.7%)를 세부적으로 살펴보면 불완전한 수술이 된 경우(5예)와 수술 시에 일반적으로 포함되는 수술의 범위가 아닌 위치에 전이림프절이 있는 경우(9예)가 있었다. 불완전한 수술이 진행된 경우에 잔존 림프절이 중앙경부구획(제6구획) 및 제2, 3, 4구획에 존재하여 외과의사가 수술 시 정확한 절제범위 숙지하여 수술을 진행하면 제거할 수 있는 부위에 위치하였다(Table 5).
초기 수술 시 일반적으로 포함되는 수술의 범위가 아닌 위치에 전이 림프절이 있는 경우에도 재수술 시에는 해당 림프절을 목표로 하여 수술을 시행하면 대부분 제거할 수 있었다. 따라서 이 역시 수술 전에 영상의학과 의사와 전이 림프절의 범위를 명확히 규명하고, 접근하기 어려운 부위에 있는 림프절을 외과 의사가 목표로 한 전이 림프절이 제거되었는지를 수술 중 확인한다면 수술의 완전도를 높일 수 있을 것이다.
앞서 살펴본 여러 사례의 개선을 위해 갑상선 암의 경부 림프절 전이 확인을 위해 수술 전 검사인 초음파 및 컴퓨터 단층 촬영의 정확도를 높이기 위한 노력 또한 필요하다. 본원의 재발 사례들을 살펴보면서 갑상선 영상을 전문으로 하는 영상의학과 의사가 판독을 하면서 진단의 정확도가 높아졌고, 컴퓨터 단층 촬영의 프로토콜을 갑상선암의 림프절 전이를 진단하는데 최적화시키는 과정을 통해 위 음성률을 줄일 수 있는 가능성을 보았다.
수술 전 다학제 수술 환자 사례 회의를 통해 수술범위를 명확히 설정하여 수술을 시행하는 것도 도움이 되는데, 수술 시 접근이 어렵거나 놓치기 쉬운 부위에 위치한 림프절의 제거를 위해 수술 전 초음파 유도 하 염색 주사(Ultrasound guided dye injection)등을 이용하여 미리 표시를 한 뒤 해당 부위 수술 후 육안으로 림프절을 제거를 확인하는 것이 필요할 수 있다[18-20].
본 연구는 갑상선 유두암은 재발 수술 후 치료반응을 평가함에 있어 우수반응이 87예(79.1%)로 재발 수술 및 치료 후 결과는 우수했다. 하지만 일부 경우는 재수술 및 추가 치료에도 불구하고 완전한 관해에 이르지 못하였다. 특히 이러한 환자의 경우 반복적인 재수술 또는 재수술 시 유착으로 인한 수술적 제거의 어려움을 가질 수 있으므로, 이러한 사례를 고려해 볼 때 초기 수술에서 명확히 수술범위를 설정하고 전이 림프절의 완전 제거를 목표로 하는 것이 재수술을 최소화하는 데에 도움이 되겠다[21,22].
연구의 한계로는 갑상선 암의 재발 사례를 전향적 연구로 계획하는 데에 많은 어려움이 있으며, 후향적 연구로 진단 기술적 보완과 수술자의 주의로 인해 얼마나 재발률을 개선할 수 있을지는 결론을 내릴 수 없다. 또한 분석한 모집단의 수도 크지 않아 향후 더 큰 모집단과 다기관 연구를 통한 포괄적 연구 진행이 필요하다.
결론
갑상선 유두암은 일반적으로 느리게 진행함에도 불구하고 비교적 이른 재발의 시기를 갖는다. 본 연구에서는 경부 림프절 재발로 인한 재수술 환자의 약 50%는 수술 전 없었거나 수술 후 제거된 부위에서 새롭게 발생하였으나, 약 50%에서는 수술 전 진단이 부적절 했거나 수술 시 불완전한 수술이 시행된 것으로 확인되었다. 따라서 수술 전 영상검사의 면밀한 시행을 통해 진단의 정확도를 높이고, 외과의사가 완전한 수술적 절제를 위해 노력하는 등의 다학제적 접근을 통해 갑상선 유두암의 경부 림프절 재발 수술을 줄일 수 있을 것으로 사료된다.